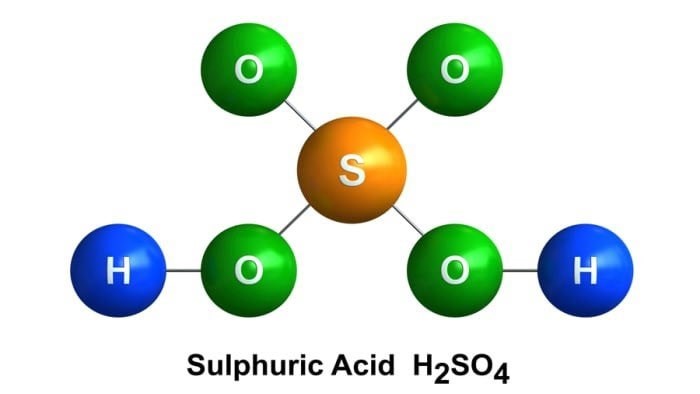
Phương trình S + H2SO4 loãng là một trong những phản ứng hóa học quan trọng và thường được đề cập trong các lĩnh vực như hóa học, công nghiệp và môi trường. Phản ứng này mô tả sự tương tác giữa lưu huỳnh (S) và axit sunfuric loãng (H2SO4), dẫn đến sự hình thành các sản phẩm quan trọng. Hiểu rõ về phương trình này không chỉ giúp bạn nắm vững kiến thức hóa học mà còn có thể ứng dụng trong nhiều lĩnh vực thực tế.
Trong bài viết này, hãy cùng Học văn vui vẻ tìm hiểu chi tiết về phương trình S + H2SO4 loãng, bao gồm các thông tin liên quan về phản ứng này. Hãy cùng tìm hiểu sâu hơn về phương trình quan trọng này nhé!

Định nghĩa và mô tả phương trình S + H2SO4 loãng
Phương trình S + H2SO4 loãng mô tả sự tương tác giữa lưu huỳnh (S) và axit sunfuric loãng (H2SO4). Khi lưu huỳnh và axit sunfuric loãng được đưa vào phản ứng, sẽ xảy ra một loạt các quá trình hóa học, dẫn đến sự hình thành các sản phẩm mới.
Phản ứng có thể được viết dưới dạng phương trình hóa học như sau:
S + 2H2SO4 → 3SO2 + 2H2O
Trong phương trình này, lưu huỳnh (S) và axit sunfuric loãng (H2SO4) là các chất tham gia phản ứng. Các sản phẩm của phản ứng bao gồm khí sunfurơ dioxide (SO2) và nước (H2O).
Quá trình diễn ra như sau:
- Lưu huỳnh (S) tham gia phản ứng với axit sunfuric loãng (H2SO4).
- Trong môi trường axit, lưu huỳnh sẽ bị oxy hóa, tạo thành khí sunfurơ dioxide (SO2).
- Đồng thời, một phần axit sunfuric loãng sẽ bị khử, tạo thành nước (H2O).
Kết quả là chúng ta thu được các sản phẩm là khí sunfurơ dioxide (SO2) và nước (H2O).
Các sản phẩm của phản ứng
Như đã đề cập, các sản phẩm chính của phương trình S + H2SO4 loãng là:
- Khí sunfurơ dioxide (SO2)
- Nước (H2O)
Cùng tìm hiểu chi tiết về từng sản phẩm này:
- Khí sunfurơ dioxide (SO2)
Sunfurơ dioxide (SO2) là một khí không màu, có mùi khó chịu, được tạo ra khi lưu huỳnh tham gia phản ứng với axit sunfuric loãng. SO2 là một sản phẩm quan trọng của phản ứng và có nhiều ứng dụng trong công nghiệp và môi trường.
Một số đặc điểm của khí SO2:
- Công thức hóa học: SO2
- Trạng thái ở nhiệt độ và áp suất thường: Khí
- Mùi: Có mùi hăng, khó chịu
- Màu sắc: Không màu
- Tan trong nước: Có
- Độc tính: Độc với con người và môi trường
SO2 được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất giấy, hóa chất, chế biến thực phẩm, và xử lý nước thải. Tuy nhiên, khí này cũng gây ô nhiễm không khí và có thể gây hại cho sức khỏe con người và môi trường nếu không được kiểm soát tốt.
- Nước (H2O)
Sản phẩm thứ hai của phản ứng S + H2SO4 loãng là nước (H2O). Nước là chất lỏng vô cùng quan trọng, được tạo ra khi một phần axit sunfuric loãng bị khử trong quá trình phản ứng.
Một số đặc điểm của nước:
- Công thức hóa học: H2O
- Trạng thái ở nhiệt độ và áp suất thường: Chất lỏng
- Màu sắc: Không màu
- Mùi: Không mùi
- Tính chất: Không độc, lành tính
- Ứng dụng: Rất quan trọng trong nhiều lĩnh vực như sinh học, công nghiệp, nông nghiệp, v.v.
Nước là một trong những sản phẩm quan trọng của phương trình S + H2SO4 loãng. Sự hình thành nước trong phản ứng này góp phần làm giảm nồng độ axit sunfuric, điều này có thể ảnh hưởng đến tốc độ và hiệu suất của phản ứng.
Ứng dụng của phương trình S + H2SO4 loãng
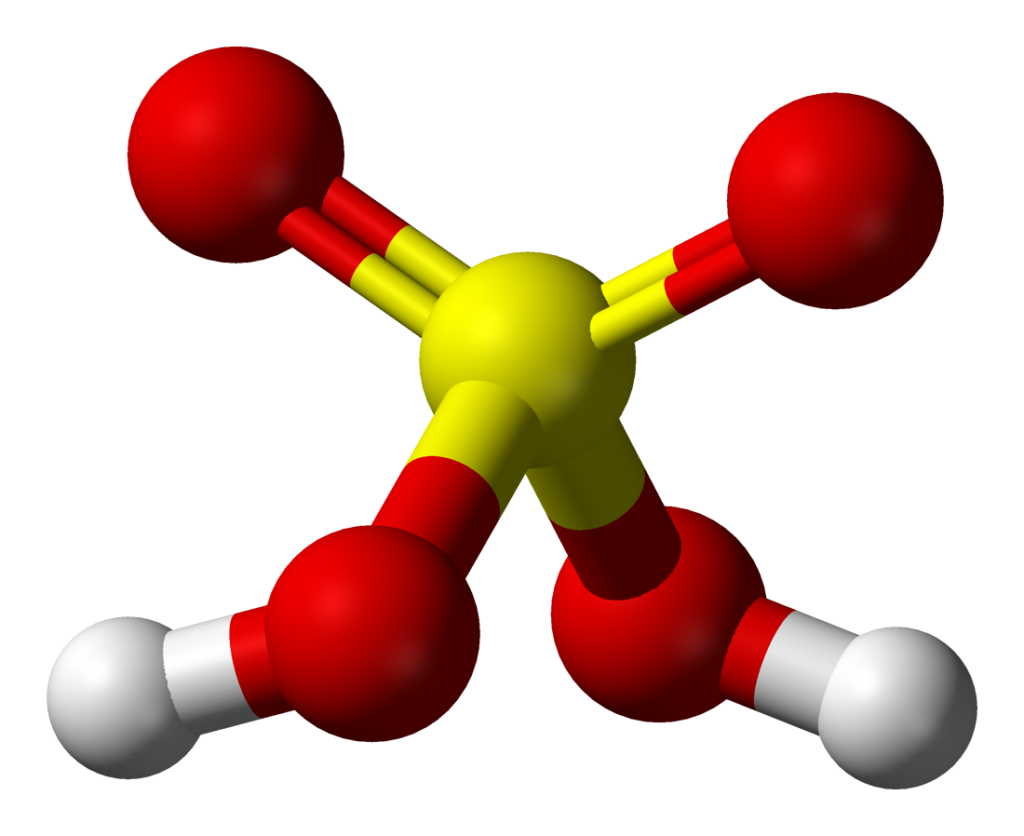
Phương trình S + H2SO4 loãng có nhiều ứng dụng quan trọng trong các lĩnh vực như hóa học, công nghiệp và môi trường. Cùng tìm hiểu một số ứng dụng chính của phương trình này:
- Sản xuất axit sunfuric
Một trong những ứng dụng chính của phương trình S + H2SO4 loãng là trong quá trình sản xuất axit sunfuric (H2SO4). Axit sunfuric là một trong những hóa chất công nghiệp quan trọng nhất, được sử dụng rộng rãi trong nhiều ngành như sản xuất phân bón, hóa chất, dược phẩm, v.v.
Trong quá trình sản xuất axit sunfuric, phương trình S + H2SO4 loãng được sử dụng để tạo ra khí sunfurơ dioxide (SO2), làm nguyên liệu đầu vào cho các bước tiếp theo của quy trình sản xuất.
- Xử lý khí thải
Phương trình S + H2SO4 loãng cũng được ứng dụng trong việc xử lý khí thải chứa lưu huỳnh. Trong một số quá trình công nghiệp, khí thải có thể chứa lượng lưu huỳnh cao, gây ô nhiễm môi trường. Bằng cách cho khí thải phản ứng với axit sunfuric loãng, lưu huỳnh sẽ được chuyển hóa thành khí sunfurơ dioxide, có thể được thu hồi và tái sử dụng.
Quá trình xử lý này giúp giảm thiểu lượng lưu huỳnh thải ra môi trường, góp phần bảo vệ môi trường.
- Sản xuất phân bón
Một ứng dụng khác của phương trình S + H2SO4 loãng là trong sản xuất phân bón. Khí sunfurơ dioxide (SO2) tạo ra từ phản ứng này có thể được sử dụng để sản xuất axit sunfuric, là thành phần quan trọng trong các loại phân bón như superphosphate.
Phân bón chứa lưu huỳnh và sunfat rất cần thiết cho sự phát triển của nhiều loại cây trồng, do đó phương trình S + H2SO4 loãng đóng vai trò quan trọng trong ngành nông nghiệp.
- Sản xuất hóa chất
Ngoài ra, phương trình S + H2SO4 loãng còn được ứng dụng trong sản xuất một số hóa chất khác như axit sunfit, sulfat, v.v. Các sản phẩm của phản ứng này có thể được sử dụng làm nguyên liệu đầu vào cho các quá trình sản xuất hóa chất khác.
Như vậy, phương trình S + H2SO4 loãng có nhiều ứng dụng quan trọng trong các lĩnh vực công nghiệp, hóa học và môi trường. Hiểu rõ về phương trình này giúp chúng ta nắm bắt được các quá trình hóa học cơ bản và ứng dụng chúng vào thực tế.
Điều kiện và yếu tố ảnh hưởng đến phản ứng
Để phản ứng S + H2SO4 loãng diễn ra một cách hiệu quả, cần phải đảm bảo các điều kiện và yếu tố ảnh hưởng thích hợp. Cùng tìm hiểu một số yếu tố quan trọng sau:
- Nồng độ axit sunfuric
Nồng độ của axit sunfuric (H2SO4) là yếu tố rất quan trọng ảnh hưởng đến quá trình phản ứng. Phương trình S + H2SO4 loãng chỉ xảy ra khi axit sunfuric có nồng độ thấp, thường khoảng 10-20%. Nếu nồng độ axit quá cao, phản ứng sẽ diễn ra chậm hơn hoặc thậm chí không xảy ra.
- Nhiệt độ
Nhiệt độ cũng là một yếu tố ảnh hưởng đến tốc độ và hiệu suất của phản ứng. Thông thường, phản ứng S + H2SO4 loãng diễn ra tốt nhất ở nhiệt độ cao, khoảng 300-400°C. Ở nhiệt độ thấp hơn, tốc độ phản ứng sẽ chậm hơn.
- Kích thước hạt lưu huỳnh
Kích thước hạt của lưu huỳnh cũng ảnh hưởng đến quá trình phản ứng. Lưu huỳnh có kích thước hạt nhỏ sẽ có diện tích tiếp xúc lớn hơn với axit sunfuric, do đó phản ứng sẽ diễn ra nhanh hơn.
- Thời gian tiếp xúc
Thời gian tiếp xúc giữa lưu huỳnh và axit sunfuric cũng là yếu tố quan trọng. Phản ứng cần một khoảng thời gian nhất định để hoàn thành, thường khoảng 2-3 giờ. Nếu thời gian tiếp xúc quá ngắn, phản ứng sẽ không kịp diễn ra đầy đủ.
Vì vậy, để đạt được hiệu quả tối ưu của phương trình S + H2SO4 loãng, cần phải điều chỉnh và kiểm soát tốt các yếu tố như nồng độ axit, nhiệt độ, kích thước hạt lưu huỳnh và thời gian tiếp xúc.
Cách cân bằng phương trình
Để cân bằng phương trình S + H2SO4 loãng, chúng ta cần xác định số nguyên tử của các nguyên tố tham gia phản ứng và điều chỉnh các hệ số sao cho tổng số nguyên tử trước và sau phản ứng là như nhau.
Phương trình cân bằng có thể được viết như sau:
S + 2H2SO4 → 3SO2 + 2H2O
Giải thích cách cân bằng phương trình:
Xác định số nguyên tử của mỗi nguyên tố:
- Lưu huỳnh (S): 1 nguyên tử
- Hydro (H): 4 nguyên tử
- Oxy (O): 8 nguyên tử
- Sunfur (S): 3 nguyên tử
Cân bằng phương trình bằng cách điều chỉnh các hệ số:
- Lưu huỳnh (S): 1 nguyên tử ở bên trái, 3 nguyên tử ở bên phải
- Hydro (H): 4 nguyên tử ở bên trái, 2 nguyên tử ở bên phải
- Oxy (O): 8 nguyên tử ở bên trái, 6 nguyên tử ở bên phải
Kiểm tra lại tổng số nguyên tử trước và sau phản ứng:
- Tổng số nguyên tử trước phản ứng: 1 (S) + 4 (H) + 8 (O) = 13
- Tổng số nguyên tử sau phản ứng: 3 (SO2) + 2 (H2O) = 13
Như vậy, phương trình S + 2H2SO4 → 3SO2 + 2H2O đã được cân bằng đúng với tổng số nguyên tử trước và sau phản ứng.
Một số lưu ý khi thực hiện phản ứng
Khi thực hiện phản ứng S + H2SO4 loãng, cần lưu ý một số điều sau để đảm bảo hiệu quả và an toàn cho quá trình:
An toàn lao động
- Đảm bảo sử dụng trang thiết bị bảo hộ cá nhân như kính bảo hộ, găng tay, áo áo chống hóa chất khi tiếp xúc với axit sunfuric và lưu huỳnh.
- Luôn thực hiện phản ứng trong môi trường thoáng khí và có hệ thống thông gió tốt để đảm bảo an toàn cho người thực hiện.
Kiểm soát nhiệt độ
- Đảm bảo kiểm soát nhiệt độ của phản ứng để tránh sự cố hoặc tai nạn do tăng nhiệt độ đột ngột.
- Sử dụng thiết bị điều chỉnh nhiệt độ như bếp hâm hoặc lò điều chỉnh.
Kiểm soát nồng độ axit
- Đảm bảo sử dụng axit sunfuric loãng với nồng độ phù hợp, không sử dụng axit có nồng độ quá cao để tránh nguy cơ tai nạn hoặc phản ứng không mong muốn.
Thực hiện trong môi trường kiểm soát
- Thực hiện phản ứng trong môi trường kiểm soát, có các biện pháp phòng cháy nổ và xử lý rủi ro hóa chất.
Kết luận
Phương trình S + H2SO4 loãng là một trong những phản ứng hóa học quan trọng, mang lại các sản phẩm có nhiều ứng dụng trong thực tế. Hiểu rõ về phương trình này không chỉ giúp củng cố kiến thức hóa học mà còn giúp áp dụng vào nhiều lĩnh vực khác nhau như công nghiệp, môi trường, nông nghiệp, v.v.
Trong bài viết này, chúng ta đã tìm hiểu chi tiết về định nghĩa và mô tả của phương trình, các sản phẩm của phản ứng, ứng dụng trong thực tế, điều kiện và yếu tố ảnh hưởng đến phản ứng, cách cân bằng phương trình và một số lưu ý khi thực hiện phản ứng.
Học văn vui vẻ hy vọng rằng thông tin trong bài viết sẽ giúp bạn hiểu rõ hơn về phản ứng hóa học quan trọng này và áp dụng vào thực tế một cách hiệu quả. Hãy luôn tuân thủ các quy định an toàn và thực hiện phản ứng một cách cẩn thận để đạt được kết quả tốt nhất. Chúc bạn thành công!