Các phản ứng hóa học đóng vai trò vô cùng quan trọng, không chỉ trong nghiên cứu khoa học mà còn trong nhiều lĩnh vực công nghiệp khác nhau. Một trong những phản ứng hóa học quan trọng đó chính là phản ứng giữa lưu huỳnh (S) và axit sulfuric đặc nóng (H2SO4).
Phản ứng này không chỉ mang tính lý thuyết mà còn có nhiều ứng dụng thiết thực trong công nghiệp, đặc biệt là trong sản xuất axit sulfuric – một trong những hóa chất công nghiệp quan trọng nhất. Vì vậy, việc hiểu rõ về phương trình phản ứng này, cũng như các yếu tố ảnh hưởng đến quá trình phản ứng, là vô cùng cần thiết.
Trong bài viết này Học văn vui vẻ sẽ tìm hiểu chi tiết về phương trình phản ứng S (lưu huỳnh) + H2SO4 đặc nóng, bao gồm các thông tin về cơ chế phản ứng, các yếu tố ảnh hưởng, cũng như những ứng dụng quan trọng của phản ứng này trong công nghiệp.
Cơ Chế Phản Ứng S (Lưu Huỳnh) + H2SO4 Đặc Nóng
Phản ứng giữa lưu huỳnh (S) và axit sulfuric đặc nóng (H2SO4) có thể được mô tả bằng phương trình hóa học như sau:
S (s) + 2H2SO4 (l, nóng) → 3SO2 (g) + 2H2O (l)
Trong đó:
- S (s): Lưu huỳnh ở thể rắn
- H2SO4 (l, nóng): Axit sulfuric đặc ở thể lỏng, được gia nhiệt
- SO2 (g): Khí dioxide lưu huỳnh
- H2O (l): Nước ở thể lỏng
Cơ chế phản ứng có thể được mô tả như sau:
- Khi lưu huỳnh (S) tiếp xúc với axit sulfuric đặc nóng (H2SO4), lưu huỳnh sẽ bị oxy hóa, tạo thành khí dioxide lưu huỳnh (SO2).
- Trong quá trình này, axit sulfuric đóng vai trò là chất oxy hóa, lấy oxy từ lưu huỳnh để tạo thành SO2.
- Đồng thời, H2SO4 cũng bị khử, tạo thành nước (H2O).
Phản ứng này là một phản ứng quan trọng trong công nghiệp sản xuất axit sulfuric, vì nó cung cấp nguồn SO2 – một trong những nguyên liệu chính để sản xuất axit sulfuric.
Các Yếu Tố Ảnh Hưởng Đến Phản Ứng
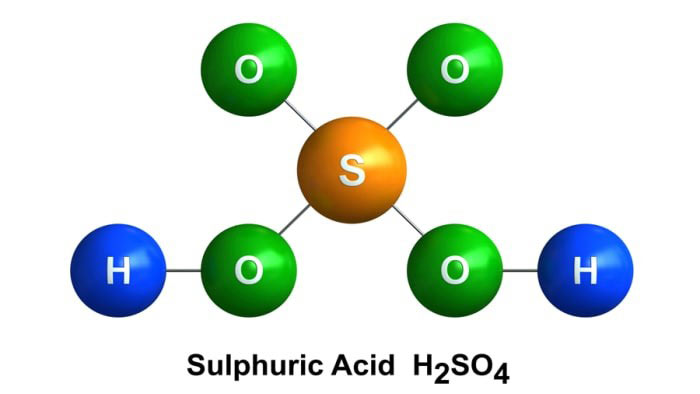
Để hiểu rõ hơn về phản ứng S (lưu huỳnh) + H2SO4 đặc nóng, chúng ta cần xem xét các yếu tố ảnh hưởng đến quá trình phản ứng, bao gồm:
1. Nhiệt Độ
Nhiệt độ là một trong những yếu tố quan trọng ảnh hưởng đến tốc độ và hiệu suất của phản ứng. Ở nhiệt độ thường, phản ứng diễn ra rất chậm. Tuy nhiên, khi gia nhiệt axit sulfuric lên, tốc độ phản ứng sẽ tăng lên đáng kể.
Lý do là do gia nhiệt sẽ làm tăng động năng của các phân tử, từ đó tăng khả năng va chạm và tương tác giữa các phân tử, thúc đẩy quá trình phản ứng diễn ra nhanh hơn.
2. Nồng Độ H2SO4
Nồng độ của axit sulfuric cũng ảnh hưởng đáng kể đến quá trình phản ứng. Khi sử dụng axit sulfuric đặc (nồng độ cao), tốc độ phản ứng sẽ nhanh hơn so với khi sử dụng axit sulfuric pha loãng.
Điều này là do axit sulfuric đặc có khả năng oxy hóa lưu huỳnh mạnh hơn so với axit pha loãng. Ngoài ra, axit sulfuric đặc cũng có khả năng hấp thụ nhiệt tốt hơn, từ đó duy trì nhiệt độ phản ứng ở mức cao hơn.
3. Diện Tích Tiếp Xúc
Diện tích tiếp xúc giữa lưu huỳnh và axit sulfuric cũng ảnh hưởng đến tốc độ phản ứng. Khi lưu huỳnh có diện tích tiếp xúc lớn hơn (ví dụ như dạng bột mịn), tốc độ phản ứng sẽ nhanh hơn so với khi lưu huỳnh ở dạng khối.
Điều này là do khi lưu huỳnh có diện tích tiếp xúc lớn hơn, số lượng các phân tử lưu huỳnh tiếp xúc với axit sulfuric sẽ nhiều hơn, từ đó thúc đẩy quá trình phản ứng diễn ra nhanh hơn.
4. Áp Suất
Áp suất cũng là một yếu tố ảnh hưởng đến phản ứng S (lưu huỳnh) + H2SO4 đặc nóng. Khi áp suất tăng, tốc độ phản ứng sẽ tăng lên.
Lý do là do khi áp suất tăng, nồng độ các phân tử tham gia phản ứng trong thể tích nhất định sẽ tăng lên, từ đó làm tăng khả năng va chạm và tương tác giữa các phân tử, thúc đẩy quá trình phản ứng diễn ra nhanh hơn.
Tuy nhiên, cần lưu ý rằng việc tăng áp suất quá mức cũng có thể gây ra những rủi ro về an toàn, do đó cần được thực hiện cẩn thận và có các biện pháp phòng ngừa thích hợp.
Ứng Dụng Của Phản Ứng S (Lưu Huỳnh) + H2SO4 Đặc Nóng

Phản ứng S (lưu huỳnh) + H2SO4 đặc nóng có nhiều ứng dụng quan trọng trong công nghiệp, đặc biệt là trong sản xuất axit sulfuric. Cụ thể:
1. Sản Xuất Axit Sulfuric
Phản ứng này là một trong những bước quan trọng trong quá trình sản xuất axit sulfuric (H2SO4) – một trong những hóa chất công nghiệp quan trọng nhất. Axit sulfuric có rất nhiều ứng dụng trong các ngành công nghiệp như hóa chất, phân bón, dầu mỏ, v.v.
Trong quá trình sản xuất axit sulfuric, SO2 thu được từ phản ứng S (lưu huỳnh) + H2SO4 đặc nóng sẽ được sử dụng làm nguyên liệu đầu vào cho các công đoạn tiếp theo như oxy hóa SO2 thành SO3, rồi hấp thụ SO3 vào nước để tạo thành axit sulfuric.
2. Sản Xuất Các Hóa Chất Khác
Ngoài axit sulfuric, phản ứng S (lưu huỳnh) + H2SO4 đặc nóng còn được ứng dụng để sản xuất các hóa chất khác như amoniac, axit nitric, axit phosphoric, v.v. Các hóa chất này đóng vai trò quan trọng trong nhiều ngành công nghiệp.
3. Sản Xuất Phân Bón
Axit sulfuric có vai trò quan trọng trong sản xuất các loại phân bón như phân lân, phân super lân, phân NPK, v.v. Phản ứng S (lưu huỳnh) + H2SO4 đặc nóng là một trong những nguồn cung cấp axit sulfuric cho các quá trình sản xuất phân bón này.
4. Ứng Dụng Trong Luyện Kim
Trong ngành luyện kim, axit sulfuric được sử dụng để tách kim loại từ quặng. Phản ứng S (lưu huỳnh) + H2SO4 đặc nóng có thể cung cấp nguồn SO2 cho các quá trình luyện kim này.
5. Sử Dụng Trong Công Nghiệp Dầu Mỏ
Trong công nghiệp dầu mỏ, axit sulfuric được sử dụng để tách các tạp chất như lưu huỳnh, nitơ, v.v. khỏi các sản phẩm dầu mỏ. Phản ứng S (lưu huỳnh) + H2SO4 đặc nóng có thể cung cấp nguồn axit sulfuric cho các quá trình tinh chế dầu mỏ này.
Như vậy, có thể thấy phản ứng S (lưu huỳnh) + H2SO4 đặc nóng đóng vai trò vô cùng quan trọng trong nhiều ngành công nghiệp khác nhau, đặc biệt là trong sản xuất axit sulfuric và các hóa chất công nghiệp khác.
Kết Luận
Phản ứng giữa lưu huỳnh (S) và axit sulfuric đặc nóng (H2SO4) là một phản ứng quan trọng trong công nghiệp hóa học. Phản ứng này không chỉ cung cấp nguồn SO2 cho quá trình sản xuất axit sulfuric, mà còn có nhiều ứng dụng khác trong các ngành công nghiệp như hóa chất, phân bón, luyện kim, dầu mỏ, v.v.
Để hiểu rõ hơn về phản ứng này, chúng ta cần xem xét các yếu tố ảnh hưởng như nhiệt độ, nồng độ H2SO4, diện tích tiếp xúc và áp suất. Việc kiểm soát tốt các yếu tố này sẽ giúp tối ưu hóa quá trình phản ứng, từ đó nâng cao hiệu suất và năng suất sản xuất.
Học văn vui vẻ hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về phương trình phản ứng S (lưu huỳnh) + H2SO4 đặc nóng và các ứng dụng quan trọng của nó trong công nghiệp.